An den Standorten Bad Homburg, Oberursel und Friedberg haben kürzlich 45 junge Menschen ihre Ausbildung begonnen. Damit bietet Fresenius in der Region zwölf Auszubildenden mehr als im vergangenen Jahr eine Lehrstelle und aussichtsreiche berufliche Perspektiven. Mit der deutlichen Steigerung von 36 Prozent will sich der Gesundheitskonzern noch stärker bei der Berufsausbildung engagieren. „Wir wollen im In- und Ausland weiter stark wachsen und benötigen dafür auch hier in der Region hoch qualifizierte Mitarbeiterinnen und Mitarbeiter. Mit der Erhöhung der Zahl der Ausbildungsplätze stellen wir uns auch der Verantwortung, mehr jungen Menschen eine fundierte Ausbildung zu bieten", sagt Fresenius-Ausbildungsleiter Jürgen Muthig.
Der neue Jahrgang deckt alle angebotenen Ausbildungsrichtungen bei Fresenius in der Region ab, darunter drei kaufmännische, drei naturwissenschaftliche und fünf technische Berufe sowie zwei duale Studiengänge in Kooperation mit Berufsakademien in Mannheim und Bad Homburg.
Den größten Zuwachs verzeichnen die Diplom-Wirtschaftsinformatiker: Statt zwei Studenten bietet Fresenius dieses Jahr fünf diese Kombination von Studium und Ausbildung. Inhaltlich erweitert hat der Konzern die Ausbildung zum Fachinformatiker, die neben der Anwendungsentwicklung nun auch auf Systemintegration ausgerichtet ist.
Die vielfältige Berufsausbildung bei Fresenius genießt einen guten Ruf: Das zeigt die große Zahl von rund 1.300 Bewerbungen und der wachsende Anteil von Auszubildenden, die von außerhalb Hessens kommen, darunter viele aus den neuen Bundesländern und Norddeutschland.
Bewerbungen für das Ausbildungsjahr 2008 nimmt Fresenius schon jetzt gerne entgegen. Erstmals wird der Gesundheitskonzern dann einen oder mehrere Informatikkaufleute ausbilden. Einen direkten Einblick in alle Ausbildungsgänge erhalten Bewerber beim „Tag der offenen Tür" der Fresenius-Berufsausbildung am Samstag, 24. November 2007.
Weitere Informationen zum Unternehmen, zu den verschiedenen Ausbildungsgängen und zum „Tag der offenen Tür" unter Karriere / Ausbildung.
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.06.2007 beschäftigte der Fresenius-Konzern weltweit 108.860 Mitarbeiterinnen und Mitarbeiter.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Vorstand: Dr. Ulf M. Schneider (Vorsitzender), Rainer Baule, Andreas Gaddum, Dr. Jürgen Götz, Dr. Ben Lipps, Stephan Sturm
Aufsichtsrat: Dr. Gerd Krick (Vorsitzender)
Sitz der Gesellschaft: Bad Homburg, Deutschland/Eingetragen beim Amtsgericht Bad Homburg, HRB 10660
Beruf und Familie beanspruchen die Menschen im Alltag oft bis zur Belastungsgrenze. Da ist es wichtig, auf die Gesundheit zu achten und an den eigenen Körper zu denken. Eine gute Gelegenheit dazu bietet die 10. Bad Homburger Gesundheitswoche vom 25. bis 27. Oktober, die der Gesundheitskonzern Fresenius zusammen mit der Stadt Bad Homburg und der Kur- und Kongreß-GmbH im Kurhaus veranstaltet. Dort erhalten die Besucher drei Tage lang kostenlose Tipps, Tests und Informationen rund um die Themen Vorsorge und Gesundheit.
Rund 50 Selbsthilfegruppen, Vereine, öffentliche Einrichtungen und Unternehmen haben für die Gesundheitswoche ein umfangreiches Angebot für Jung und Alt zusammengestellt. Kinder ab drei Jahren lernen im Kariestunnel spielerisch, wie sie ihre Zähne am besten putzen, und erfahren auf einer Fantasiereise, was zu einer gesunden Ernährung gehört. Außerdem gibt es für die Jungen und Mädchen ein Theaterprojekt. Die Erwachsenen können sich an den Ständen informieren, an Vorträgen teilnehmen und zahlreiche kostenlose Untersuchungen nutzen. Dazu zählen unter anderem Cholesterin-, Venen-, Blutzucker- und Körperfettmessungen sowie Hörtests. Das Herz- und Gefäßcampus Bad Nauheim bietet außerdem Ultraschallmessungen der Hals- und Bauchschlagader an. Diese Untersuchungen geben Aufschluss darüber, ob eine Arterienverkalkung vorliegt.
Darüber hinaus erfahren die Besucher, wie sie sich gesund ernähren und welche Impfungen bei Fernreisen erforderlich sind. Außerdem bieten die Klinik Dr. Baumstark und weitere Krankenhäuser aus der Region zahlreiche Vorträge unter anderem zu den Themen Diabetes, Übergewicht, Gelenkerkrankungen und Demenz an. Wer sich gleich selbst körperlich betätigen möchte, hat dazu ebenfalls Gelegenheit: etwa bei der Wirbelsäulengymnastik, Mobilisations- und Kräftigungsgymnastik, beim Knie- und Hüftgelenktraining, bei Atemübungen zur Stressreduktion, der Klangmassage, beim Yoga, Taiji und QiGong.
Mit rund 20.000 Besuchern an drei Ausstellungstagen zählt die Bad Homburger Gesundheitswoche zu den größten Gesundheitsveranstaltungen Deutschlands. Sie ist am Donnerstag und Freitag, 25. und 26. Oktober, von 10 bis 18 Uhr sowie am Samstag, 27. Oktober, von 10 bis 16 Uhr geöffnet.
Die Bad Homburger Gesundheitswoche ist das Ergebnis einer bundesweit einmaligen Zusammenarbeit zwischen Privatwirtschaft und städtischen Einrichtungen. Sie wird seit 1989 von der Fresenius SE, der Stadt Bad Homburg und der Kur- und Kongreß-GmbH organisiert und finanziert. Die Veranstalter verzichten bewusst auf Fachvorträge hochrangiger Wissenschaftler und stellen den praktischen Nutzen in Form individueller Tests und Informationen in den Vordergrund. Die Informationen und Tests ersetzen zwar nicht die ärztliche Beratung, geben aber wichtige Denkanstöße, wie die eigene Gesundheit verbessert werden kann.
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.06.2007 beschäftigte der Fresenius-Konzern weltweit 108.860 Mitarbeiterinnen und Mitarbeiter.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Vorstand: Dr. Ulf M. Schneider (Vorsitzender), Rainer Baule, Andreas Gaddum, Dr. Jürgen Götz, Dr. Ben Lipps, Stephan Sturm
Aufsichtsrat: Dr. Gerd Krick (Vorsitzender)
Sitz der Gesellschaft: Bad Homburg, Deutschland/Eingetragen beim Amtsgericht Bad Homburg, HRB 10660
Die Besucher der 10. Bad Homburger Gesundheitswoche erwartet vom 25. bis 27. Oktober im Kurhaus ein deutlich erweitertes Veranstaltungsprogramm rund um die Themen Vorsorge und Gesundheit. An den drei Tagen werden insgesamt 40 kostenlose Vorträge, Kurse und Workshops angeboten – viermal so viele wie vor zwei Jahren. „Wir möchten, dass die Menschen im Alltag fit und gesund bleiben. Deshalb haben wir unser Beratungsprogramm stark ausgebaut", sagt Veranstaltungsleiterin Daniela Hegemann vom Gesundheitskonzern Fresenius. „Man darf Gesundheit nicht als etwas Selbstverständliches betrachten", betont Bad Homburgs Oberbürgermeisterin Dr. Ursula Jungherr. „Ich freue mich deshalb, wenn viele Besucher das Angebot der Gesundheitswoche wahrnehmen."
Experten aus mehreren Kliniken in der Region informieren bei Vorträgen unter anderem über Diabetes, Arterienerkrankungen, Übergewicht, Blasenschwäche, Herzinfarkt, Arthrose, Depression, Halsschlagaderverengung, Brustkrebs, Demenz und Gallensteine. Wer sich gleich selbst körperlich betätigen möchte, hat dazu ebenfalls Gelegenheit: etwa bei der Wirbelsäulengymnastik, Mobilisations- und Kräftigungsgymnastik, beim Knie- und Hüftgelenktraining, bei Atemübungen zur Stressreduktion, der Klangmassage, beim Yoga, Tai Chi und QiGong. Kinder erfahren am Donnerstag und Freitag jeweils um 11.15 Uhr bei einem Workshop, was zu einer gesunden Ernährung gehört, und lernen im an allen drei Tagen durchgängig geöffneten Kariestunnel, wie sie ihre Zähne richtig putzen.
Einen besonderen Akzent setzt die Theatergruppe Sandkörner vom Psychosozialen Zentrum in Wetzlar am Donnerstag um 16 Uhr: In ihrem Stück „I did it my way" bringen die Schauspieler einen Teil ihrer eigenen Lebensgeschichte ein.
Im großen Saal des Kurhauses bieten rund 50 Selbsthilfegruppen, Vereine, öffentliche Einrichtungen und Unternehmen drei Tage lang an ihren Ständen Informationen und zahlreiche kostenlose Untersuchungen an, darunter Venen- und Körperfettmessungen sowie Hörtests. Bei Fresenius können die Besucher außerdem ihre Blutzucker- und Cholesterinwerte überprüfen lassen. Dafür müssen sie sich zu Beginn ihres Besuchs am Fresenius-Stand lediglich einen Termin geben lassen. Ein Sanitätshaus lädt darüber hinaus zu Testfahrten mit Elektro-Rollstühlen über unterschiedliche Bodenbeläge ein. Das Herz- und Gefäßcampus Bad Nauheim führt am Freitag ganztägig Ultraschallmessungen der Hals- und Bauchschlagader durch. Diese Untersuchungen geben Aufschluss darüber, ob eine Arterienverkalkung vorliegt.
Mit rund 20.000 Besuchern an drei Ausstellungstagen zählt die Bad Homburger Gesundheitswoche zu den größten Gesundheitsveranstaltungen Deutschlands. Sie wird seit 1989 alle zwei Jahre von der Fresenius SE, der Stadt Bad Homburg und der Kur- und Kongreß-GmbH organisiert und finanziert. Die Veranstalter stellen den praktischen Nutzen in Form individueller Tests und Informationen in den Vordergrund. Die Informationen und Tests ersetzen zwar nicht die ärztliche Beratung, geben aber wichtige Denkanstöße, wie die eigene Gesundheit verbessert werden kann.
Die Bad Homburger Gesundheitswoche im Kurhaus ist am Donnerstag und Freitag, 25. und 26. Oktober, von 10 bis 18 Uhr sowie am Samstag, 27. Oktober, von 10 bis 16 Uhr geöffnet. Der Eintritt ist frei. Weitere Informationen und das Programm sind im Internet erhältlich unter www.fresenius.de/gesundheitswoche.
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.06.2007 beschäftigte der Fresenius-Konzern weltweit 108.860 Mitarbeiterinnen und Mitarbeiter.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Vorstand: Dr. Ulf M. Schneider (Vorsitzender), Rainer Baule, Andreas Gaddum, Dr. Jürgen Götz, Dr. Ben Lipps, Stephan Sturm
Aufsichtsrat: Dr. Gerd Krick (Vorsitzender)
Sitz der Gesellschaft: Bad Homburg, Deutschland/Eingetragen beim Amtsgericht Bad Homburg, HRB 10660
rezg
Kennzahlen für das dritte Quartal 2007
- Umsatz: 2.426 Mio. US-$, + 9%
- Operatives Ergebnis (EBIT): 397 Mio. US-$, + 14%
- Quartalsergebnis: 181 Mio. US-$, + 30%
- Gewinn je Aktie: 0,61 US-$, + 29%
Kennzahlen für die ersten neun Monate 2007
- Umsatz: 7.151 Mio. US-$, + 16%
- Operatives Ergebnis (EBIT): 1.152 Mio. US-$, + 19%
- Ergebnis: 520 Mio. US-$, + 35%
- Gewinn je Aktie: 1,76 US-$, + 34%
Drittes Quartal 2007
Umsatz
Der Gesamtumsatz hat sich im dritten Quartal 2007 gegenüber dem Vorjahreszeitraum um 9% auf 2,426 Milliarden US-Dollar erhöht (6% währungsbereinigt). Das organische Umsatzwachstum belief sich auf 6%. Der Umsatz mit Dialysedienstleistungen stieg um 6% auf 1,801 Milliarden US-Dollar (4% währungsbereinigt). Der Umsatz mit Dialyseprodukten wuchs im gleichen Zeitraum um 18% auf 625 Millionen US-Dollar (12% währungsbereinigt).
In Nordamerika steigerte Fresenius Medical Care den Umsatz um 3% auf 1,660 Milliarden US-Dollar. Der Umsatz mit Dialysedienstleistungen wuchs um 1% auf 1,494 Milliarden US-Dollar. Ohne die Effekte aus dem Verkauf des Perfusionsgeschäfts stieg der Umsatz mit Dialysedienstleistungen um 3%. Die durchschnittliche Vergütung pro Behandlung in den USA erhöhte sich im dritten Quartal 2007 um 1% auf 327 US-Dollar gegenüber 324 US-Dollar im entsprechenden Vorjahreszeitraum. Der Umsatz mit Dialyseprodukten stieg um 18% auf 167 Millionen US-Dollar, was vor allem auf den starken Absatz der Hämodialysemaschinen des Typs 2008K und des Phosphatbinders PhosLo zurückzuführen ist.
Außerhalb Nordamerikas (Geschäftsregion „International") steigerte Fresenius Medical Care den Umsatz gegenüber dem dritten Quartal 2006 um 23% (14% währungsbereinigt) auf 766 Millionen US-Dollar. Der Umsatz mit Dialysedienstleistungen stieg um 32% (23% währungsbereinigt) auf 307 Millionen US-Dollar. Der Umsatz mit Dialyseprodukten erhöhte sich um 18% (9% währungsbereinigt) auf 459 Millionen US-Dollar. Dazu hat vor allem ein starker Absatz von Dialysemaschinen, Produkten für die Peritonealdialyse (Bauchfelldialyse) und von Dialysatoren (künstlichen Nieren) beigetragen.
Ertrag
Das operative Ergebnis (EBIT) von Fresenius Medical Care wuchs um 14% auf 397 Millionen US-Dollar nach 349 Millionen US-Dollar im dritten Quartal 2006. Das operative Ergebnis des Vorjahresquartals beinhaltete Einmalaufwendungen in Höhe von 7 Millionen US-Dollar für Restrukturierungen sowie Einmalerträge in Höhe von 1 Million US-Dollar, die beim Verkauf von Dialysekliniken im Zusammenhang mit der Akquisition der Renal Care Group (RCG) erzielt worden waren. Ohne diese Einmaleffekte erhöhte sich das operative Ergebnis im dritten Quartal 2007 um 12%. Die EBIT-Marge betrug 16,4% nach 15,9% im dritten Quartal 2006.
| in Millionen US-Dollar |
Q3 2007
|
Q3 2006
|
Wachstum
|
| Operatives Ergebnis (EBIT) |
397
|
349
|
+ 14%
|
| Kosten für Restruktuierungen |
-
|
7
|
|
| Einmalerträge durch den Verkauf von Dialysekliniken im Zusammenhang mit der Akquisition der Renal Care Group |
-
|
(1)
|
|
| Operatives Ergebnis (EBIT) vor Einmaleffekten |
397
|
355
|
+ 12%
|
Im Vergleich zum dritten Quartal 2006 ist die EBIT-Marge in Nordamerika ohne Berücksichtigung von Einmaleffekten um 70 Basispunkte auf 17,0% gestiegen. Gründe für die positive Entwicklung sind gestiegene Erstattungsraten, das neue Phosphatbindergeschäft (PhosLo) und eine gestiegene Nachfrage nach Dialyseprodukten. Höhere Personalkosten wurden dadurch überkompensiert. Außerhalb Nordamerikas (Geschäftsregion „International") betrug die operative Marge 17,6% und lag damit um 60 Basispunkte niedriger als im Vorjahreszeitraum. Der überwiegende Grund für diesen Rückgang war ein höheres Wachstum in Schwellenländern.
Die Nettozinsaufwendungen beliefen sich im dritten Quartal 2007 auf 95 Millionen US-Dollar nach 100 Millionen US-Dollar im dritten Quartal des Vorjahres. Dieser Rückgang ist vornehmlich auf eine verringerte Verschuldung und niedrigere durchschnittliche Zinssätze zurückzuführen sowie auf Zinserträge im Zusammenhang mit dem Eingang überfälliger Forderungen. Die Abschreibung von aktivierten Finanzierungskosten bei der teilweisen Rückzahlung von vorrangigen Krediten in Verbindung mit der Ausgabe einer Anleihe über 500 Millionen US-Dollar führte zu einer Einmalbelastung von 5 Millionen US-Dollar (3 Millionen US-Dollar netto nach Steuern) bei den Zinsaufwendungen.
Die Ertragssteuern beliefen sich auf 115 Millionen US-Dollar gegenüber 105 Millionen US-Dollar im dritten Quartal 2006. Dies entspricht einer effektiven Steuerquote von 38,0% nach 42,3% im Vorjahreszeitraum. Grund für die höhere Steuerquote im dritten Quartal 2006 war eine Steuernachzahlung in Deutschland. Ohne diesen Effekt lag die effektive Steuerquote bei 39,1%.
Das Quartalsergebnis von Fresenius Medical Care stieg im dritten Quartal 2007 um 30% auf 181 Millionen US-Dollar. Ohne Berücksichtigung der im dritten Quartal 2006 aufgetretenen Einmaleffekte wuchs das Quartalsergebnis auf vergleichbarer Basis um 27%.
| in Millionen US-Dollar |
Q3 2007
|
Q3 2006
|
Wachstum
|
| Quartalsergebnis |
181
|
139
|
+ 30%
|
| Kosten für Restruktuierungen |
-
|
5
|
|
| Einmalerträge durch den Verkauf von Dialysekliniken im Zusammenhang mit der Akquisition der Renal Care Group |
-
|
(1)
|
|
| Quartalsergebnis vor Einmaleffekten |
181
|
143
|
+ 27%
|
Der Gewinn je Aktie (EPS) stieg im dritten Quartal 2007 um 29% auf 0,61 US-Dollar pro Stammaktie nach 0,47 US-Dollar im gleichen Zeitraum des Vorjahres. Die durchschnittliche, gewichtete Zahl der Aktien betrug im dritten Quartal 2007 rund 295,8 Millionen nach 294,5 Millionen im Vorjahresquartal. Der Anstieg der Zahl ausstehender Aktien resultiert aus der Ausübung von Aktienoptionen im Jahr 2006 und in den ersten neun Monaten 2007.
Cash Flow
Der Mittelzufluss aus laufender Geschäftstätigkeit belief sich im dritten Quartal auf 382 Millionen US-Dollar. Dies entspricht etwa 16% des Umsatzes. Der starke Cash Flow beruht vor allem auf gestiegenen Erträgen und einer Reduzierung des Working Capital.
Die Netto-Investitionen lagen bei 123 Millionen US-Dollar. Daraus ergab sich ein Free Cash Flow vor Akquisitionen von 259 Millionen US-Dollar nach 40 Millionen US-Dollar auf berichteter Basis im dritten Quartal 2006. Für Akquisitionen (ohne Desinvestitionen) gab Fresenius Medical Care 24 Millionen US-Dollar aus. Der Free Cash Flow nach Akquisitionen belief sich auf 235 Millionen US-Dollar im Vergleich zu 32 Millionen US-Dollar im Vorjahreszeitraum.
Erste neun Monate 2007
Die Ergebnisse der Renal Care Group werden seit dem 1. April 2006 konsolidiert. Aus diesem Grund sind die Zahlen für die ersten neun Monate 2007 nicht unmittelbar mit denen der ersten neun Monate 2006 vergleichbar.
Umsatz und Ertrag
In den ersten neun Monaten des Geschäftsjahres 2007 wuchs der Umsatz um 16% (währungsbereinigt um 14%) auf 7,151 Milliarden US-Dollar. Der organische Umsatzanstieg betrug 7%.
Das operative Ergebnis (EBIT) stieg um 19% auf 1.152 Millionen US-Dollar nach 964 Millionen US-Dollar in den ersten neun Monaten 2006. Das operative Ergebnis des Vorjahreszeitraums beinhaltete Einmalaufwendungen in Höhe von 12 Millionen US-Dollar für Restrukturierungen und den Rechtsformwechsel von Fresenius Medical Care sowie Einmalerträge in Höhe von 40 Millionen US-Dollar, die beim Verkauf von Dialysekliniken erzielt worden waren. Ohne diese Einmaleffekte erhöhte sich das operative Ergebnis in den ersten neun Monaten 2007 um 23%. Die EBIT-Marge betrug 16,1% nach 15,2% in den ersten neun Monaten 2006.
in Millionen US-Dollar |
Q1 - Q3 |
Q1 - Q3 |
Wachstum |
| Operatives Ergebnis (EBIT) |
1.152 |
964 |
+ 19% |
| Kosten für Restruktuierungen und den Rechtsformwechsel |
- |
12 |
|
| Einmalerträge durch den Verkauf von Dialysekliniken im Zusammenhang mit der Akquisition der Renal Care Group |
- |
(40) |
|
| Operatives Ergebnis (EBIT) vor Einmaleffekten |
1.152 |
936 |
+ 23% |
Die Nettozinsaufwendungen beliefen sich in den ersten neun Monaten 2007 auf 281 Millionen US-Dollar nach 255 Millionen US-Dollar in den ersten neun Monaten 2006. Dieser Anstieg resultiert hauptsächlich aus gestiegenen Zinsaufwendungen. Gegenläufig wirkte sich vor allem die Abschreibung aktivierter Finanzierungskosten im Jahr 2006 in Höhe von 15 Millionen US-Dollar im Zusammenhang mit der Kreditvereinbarung aus dem Jahr 2003 aus. Beide stehen im Zusammenhang mit der Finanzierung der RCG-Übernahme.
Die Ertragssteuern beliefen sich in den ersten neun Monaten 2007 auf 331 Millionen US-Dollar gegenüber 314 Millionen US-Dollar im gleichen Zeitraum des Vorjahres. Dies entspricht einer Steuerquote von 38,0% nach 44,3% in den ersten neun Monaten 2006. Gründe für die höhere Steuerquote in den ersten neun Monaten 2006 waren Steueraufwendungen auf Erträge aus dem Verkauf von Dialysekliniken in den USA. Ohne diesen Effekt lag die effektive Steuerquote bei 40,3%.
Das Ergebnis in den ersten neun Monaten 2007 erhöhte sich gegenüber dem Vorjahr um 35% auf 520 Millionen US-Dollar. Ohne Berücksichtigung der in den ersten neun Monaten 2006 angefallenen Einmaleffekte wuchs das Ergebnis auf vergleichbarer Basis um 28%.
| in Millionen US-Dollar |
Q1 - Q3 |
Q1 - Q3 |
Wachstum |
| Ergebnis |
520 |
385 |
+ 35% |
| Kosten für Restruktuierungen |
- |
7 |
|
| Abschreibung aktivierter Finanzierungskosten |
- |
9 |
|
| Einmalerträge durch den Verkauf von Dialysekliniken im Zusammenhang mit der Akquisition der Renal Care Group |
- |
4 |
|
| Ergebnis vor Einmaleffekten |
520 |
405
|
+ 28% |
Der Gewinn je Aktie (EPS) betrug 1,76 US-Dollar pro Stammaktie, ein Zuwachs um 34%. Die durchschnittlich gewichtete Zahl der Aktien lag in den ersten neun Monaten 2007 bei rund 295,4 Millionen.
Cash flow
Der Mittelzufluss aus laufender Geschäftstätigkeit lag in den ersten neun Monaten 2007 bei 890 Millionen US-Dollar nach 465 Millionen US-Dollar auf Basis berichteter Zahlen in den ersten neun Monaten 2006. Ohne Einmaleffekte betrug der Cash Flow 663 Millionen US-Dollar in den ersten neun Monaten 2006. Die Zunahme resultiert hauptsächlich aus dem Ergebnisanstieg und einer Reduzierung des Working Capital.
Die Netto-Investitionen lagen bei 364 Millionen US-Dollar. Daraus ergab sich ein Free Cash Flow vor Akquisitionen von 526 Millionen US-Dollar nach 192 Millionen US-Dollar in den ersten neun Monaten 2006. Ohne die Einmaleffekte belief er sich auf 390 Millionen US-Dollar. Für Akquisitionen ohne Desinvestitionen gab Fresenius Medical Care 110 Millionen US-Dollar aus.
Eine Übersicht über die Ergebnisse des dritten Quartals und der ersten neun Monate 2007 befindet sich im Anhang.
Patienten – Kliniken – Behandlungen
Zum 30. September 2007 versorgte Fresenius Medical Care weltweit 172.227 Dialysepatienten, 7% mehr als im Vorjahr. In Nordamerika erhöhte sich die Zahl der Patienten um 3% auf 120.607. Einschließlich der 33 von Fresenius Medical Care geführten Dialysekliniken belief sich die Zahl der Patienten in den USA auf 122.479. In den Regionen außerhalb Nordamerikas (Geschäftsregion „International") stieg die Zahl der Patienten um 16% auf 51.620.
Zum 30. September 2007 betrieb das Unternehmen 2.221 Dialysekliniken weltweit, davon 1.591 in Nordamerika (+3%) und 630 außerhalb Nordamerikas (+16%).
Die Zahl der von Fresenius Medical Care weltweit durchgeführten Behandlungen stieg in den ersten neun Monaten 2007 um 13% auf etwa 19,6 Millionen. Davon entfielen 13,7 Millionen (+11%) auf Nordamerika und 5,9 Millionen (+16%) auf die Regionen außerhalb Nordamerikas, den Bereich „International".
Mitarbeiter
Zum 30. September 2007 arbeiteten 60.625 Menschen (durchschnittlich Vollzeitbeschäftigte) bei Fresenius Medical Care (31. Dezember 2006: 56.803). Der Anstieg um 3.822 Mitarbeiter resultiert zu einem großen Teil aus Akquisitionen in Asien und dem fortgesetzten organischen Wachstum in Nordamerika.
Verschuldungsgrad (Debt/EBITDA-Ratio)
Der Verschuldungsgrad (Debt/EBITDA-Ratio) reduzierte sich vom 3,44-fachen des Gewinns vor Steuern, Abschreibungen und Zinsen (EBITDA) am Ende des dritten Quartals 2006 auf 2,88 Ende des dritten Quartals 2007. Ende 2006 belief sich der Verschuldungsgrad auf 3,23.
Rating
Die Ratingagentur Standard & Poor's bewertete das Rating von Fresenius Medical Care im dritten Quartal 2007 unverändert mit „BB" und den Ausblick als „stabil". Das Rating von Moody's für Fresenius Medical Care blieb unverändert bei „Ba2" mit „positivem" Ausblick.
Zehnjährige Anleihe über 500 Millionen US-Dollar begeben
Fresenius Medical Care hat zu Beginn des dritten Quartals 2007 erstrangige, unbesicherte Schuldverschreibungen mit einer Laufzeit bis 2017 begeben. Die Anleihe hat ein Volumen von 500 Millionen US-Dollar, der Coupon beträgt 6 7/8%. Der Erlös wurde für die Reduzierung bestehender Bankkredite und sonstiger, kurzfristiger Finanzverbindlichkeiten verwendet.
Ausblick auf das Geschäftsjahr 2007 bekräftigt
Fresenius Medical Care bekräftigt den Ausblick für das Gesamtjahr 2007 und rechnet weiterhin mit einem Umsatz von mehr als 9,5 Milliarden US-Dollar. Dies entspricht einem Anstieg von mindestens 12% im Vergleich zum Vorjahr.
Beim Jahresüberschuss hatte das Unternehmen für 2007 bislang mit 685 bis 705 Millionen US-Dollar gerechnet. Wegen des sehr guten Geschäftsverlaufs im dritten Quartal erwartet Fresenius Medical Care nun, das obere Ende dieser Prognose zu erreichen.
Für Investitionen und Akquisitionen sind 2007 weiterhin insgesamt etwa 650 Millionen US-Dollar vorgesehen. Der Verschuldungsgrad (Debt/EBITDA-Ratio) soll bis zum Jahresende unter dem Wert von 3,0 liegen.
Für das Jahr 2010 erwartet Fresenius Medical Care weiterhin einen Umsatz von mehr als 11,5 Milliarden US-Dollar. Das jährliche Ergebniswachstum soll im unteren bis mittleren Zehnerprozentbereich liegen.
Ben Lipps, Vorstandsvorsitzender von Fresenius Medical Care: „Mit den Ergebnissen im dritten Quartal setzen wir unsere sehr gute Geschäftsentwicklung in diesem Jahr fort. Wir konnten diese hervorragenden Ergebnisse trotz der Herausforderungen im regulatorischen Umfeld der Dialyse in den USA erreichen. In Nordamerika haben wir sehr gute operative Margen am oberen Ende unserer Zielvorgabe erwirtschaftet. Außerhalb Nordamerikas konnten wir unser hervorragendes Umsatzwachstum im zweistelligen Prozentbereich auch während des Sommerquartals fortsetzen. Mit unserem Produktgeschäft sind wir erneut stärker als der Markt gewachsen. Der Mittelzufluss aus laufender Geschäftstätigkeit entwickelte sich sehr positiv und lag deutlich über unseren Erwartungen. Wir sind auf dem besten Weg, unsere Ziele für das laufende Jahr und das Jahr 2010 zu erreichen."
Pressekonferenz
Anlässlich der Veröffentlichung der Ergebnisse des dritten Quartals und der ersten neun Monate 2007 lädt Fresenius Medical Care für Mittwoch, 31. Oktober, zu einer Pressekonferenz ein, die um 10.00 Uhr MEZ in der Konzernzentrale in Bad Homburg beginnt. Die Pressekonferenz wird live hier im Internet übertragen. Nach der Veranstaltung steht die Aufzeichnung dort als Video-on-demand zur Verfügung.
Fresenius Medical Care ist der weltweit führende Anbieter von Produkten und Dienstleistungen für Menschen mit chronischem Nierenversagen, von denen sich weltweit mehr als 1,5 Millionen Patienten regelmäßig einer Dialysebehandlung unterziehen. In einem Netz aus 2.221 Dialysekliniken in Nordamerika, Europa, Asien, Lateinamerika und Afrika betreut Fresenius Medical Care 172.227 Dialysepatienten. Fresenius Medical Care ist ebenfalls der weltweit führende Anbieter von Dialyseprodukten wie Hämodialyse-Geräten, Dialysatoren und damit verbundenen Einweg-Produkten. Fresenius Medical Care ist an der Börse Frankfurt (FME, FME3) und an der Börse New York (FMS, FMS/P) notiert.
Weitere Informationen über Fresenius Medical Care im Internet unter www.fmc-ag.de.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie z.B. Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius Medical Care übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Fresenius Medical Care
Konzern-Gewinn- und Verlustrechnung
siehe PDF-Datei
- Umsatz: 8,4 Mrd €, + 7 % zu Ist-Kursen, + 11 % währungsbereinigt
- EBIT: 1,2 Mrd €, + 12 % zu Ist-Kursen, + 17 % währungsbereinigt
- Jahresüberschuss: 298 Mio €, + 28 % zu Ist-Kursen, + 32 % währungsbereinigt
Ausblick erhöht
Nach den ausgezeichneten Ergebnissen des 3. Quartals 2007 erwartet Fresenius nun ein währungsbereinigtes Wachstum des Konzern-Jahresüberschusses von mehr als 25 %. Der währungsbereinigte Anstieg des Konzernumsatzes wird nunmehr mit 9 bis 10 % prognostiziert. Die bisherige Prognose sah ein währungsbereinigtes Wachstum des Konzern-Jahresüberschusses von ~25 % und ein währungsbereinigtes Wachstum des Konzernumsatzes von 8 bis 10 % vor.
Nachhaltiges Wachstum: Konzernumsatz steigt währungsbereinigt um 11 %
In den ersten drei Quartalen stieg der Konzernumsatz währungsbereinigt um 11 % und zu Ist-Kursen um 7 % auf 8.390 Mio € (1.-3. Quartal 2006: 7.843 Mio €). Das organische Umsatzwachstum betrug 6 %. Akquisitionen trugen 6 % zum Umsatzanstieg bei. Desinvestitionen minderten den Umsatz um 1 %. Währungsumrechnungseffekte hatten einen negativen Einfluss von 4 %.
In Nordamerika stieg der Umsatz währungsbereinigt um 14 %. Dies ist zurückzuführen auf die Konsolidierung der Renal Care Group und auf ein organisches Wachstum von 6 %. In Europa stieg der Umsatz währungsbereinigt um 7 % und organisch um 4 %. Erneut wurden in den Wachstumsmärkten hohe organische Wachstumsraten erzielt: in der Region Asien-Pazifik wuchs der Umsatz um 9 %, in Lateinamerika um 11 % und in Afrika um 18 %.
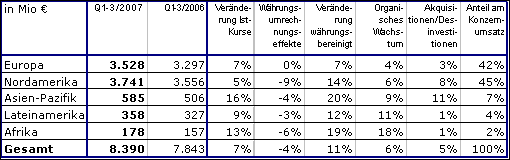
Ausgezeichnetes Ergebniswachstum: Jahresüberschuss steigt währungsbereinigt um 32 %
Der Konzern-EBITDA erhöhte sich währungsbereinigt um 15 % und zu Ist-Kursen um 10 % auf 1.485 Mio € (1.-3. Quartal 2006: 1.350 Mio €). Der Konzern-EBIT stieg währungsbereinigt um 17 % und zu Ist-Kursen um 12 % auf 1.184 Mio € (1.-3. Quartal 2006: 1.060 Mio € bzw. 1.036 Mio €, adjustiert um den Ertrag aus dem Verkauf von Dialysekliniken in den USA und Einmalaufwendungen im Zusammenhang mit der Akquisition der Renal Care Group). Die EBIT-Marge verbesserte sich weiter auf 14,1 % (1.-3. Quartal 2006: 13,5 %).
Das Zinsergebnis des Konzerns lag bei -279 Mio € (1.-3. Quartal 2006: -295 Mio €, inkl. Einmalaufwendungen von 30 Mio € für die vorzeitige Refinanzierung von Konzern-Verbindlichkeiten).
Die Steuerquote betrug 36,0 % (1.-3. Quartal 2006: 40,9 % bzw. 37,8 %, adjustiert um den Steueraufwand aus dem Verkauf von Dialysekliniken in den USA).
Der auf andere Gesellschafter entfallende Gewinn erhöhte sich auf 281 Mio € (1.-3. Quartal 2006: 219 Mio €). Davon entfielen 93 % auf Anteile anderer Gesellschafter an der Fresenius Medical Care.
Der Konzern-Jahresüberschuss übertrifft den Vorjahreswert deutlich. Fresenius erzielte ein ausgezeichnetes, währungsbereinigtes Wachstum von 32 %. Zu Ist-Kursen stieg der Konzern-Jahresüberschuss um 28 % auf 298 Mio € (1.-3. Quartal 2006: 233 Mio €, inkl. Einmalaufwendungen von 16 Mio €).
Das Ergebnis je Stammaktie erhöhte sich auf 1,92 €, das Ergebnis je Vorzugsaktie auf 1,93 € (1.-3. Quartal 2006, adjustiert um den im Februar 2007 durchgeführten Aktiensplit: Stammaktie 1,52 €, Vorzugsaktie 1,53 €). Dies entspricht einem Plus von jeweils 26 %.
Investitionsvolumen mit 727 Mio € auf hohem Niveau
Fresenius investierte im laufenden Geschäftsjahr 485 Mio € in Sachanlagen und immaterielle Vermögensgegenstände (1.-3. Quartal 2006: 374 Mio €). Das Akquisitionsvolumen belief sich auf 242 Mio € (1.-3. Quartal 2006: 3.537 Mio €).
Starker Cashflow
Der operative Cashflow stieg um 55 % auf 912 Mio € (1.-3. Quartal 2006: 588 Mio €). Dazu trug der ausgezeichnete Ergebnisanstieg bei. Im Jahr 2006 belastete ein höherer Steueraufwand infolge des Verkaufs von Dialysekliniken in den USA den Cashflow. Die Cashflow-Marge betrug 10,9 % (1.-3. Quartal 2006: 7,5 %). Der Cashflow vor Akquisitionen und Dividenden hat sich auf 447 Mio € nahezu verdoppelt (1.-3. Quartal 2006: 228 Mio €). Der Free Cashflow nach Akquisitionen (182 Mio €) und Dividenden (191 Mio €) belief sich auf 74 Mio € (1.-3. Quartal 2006: -2.986 Mio €).
Vermögens- und Kapitalstruktur: Net Debt/EBITDA verbessert
Die Bilanzsumme des Konzerns erhöhte sich währungsbereinigt um 4 % und zu Ist-Kursen nur geringfügig auf 15.054 Mio € (31. Dezember 2006: 15.024 Mio €). Das Umlaufvermögen erhöhte sich um 4 % auf 4.266 Mio € (31. Dezember 2006: 4.106 Mio €). Die langfristigen Vermögensgegenstände betrugen 10.788 Mio € (31. Dezember 2006: 10.918 Mio €).
Das Eigenkapital einschließlich der Anteile anderer Gesellschafter stieg um 4 % auf 5.946 Mio € (31. Dezember 2006: 5.728 Mio €). Die Eigenkapitalquote einschließlich der Anteile anderer Gesellschafter betrug 39,5 % (31. Dezember 2006: 38,1 %).
Die Finanzverbindlichkeiten des Konzerns reduzierten sich zu Ist-Kursen um 5 % (währungsbereinigt: -1 %) auf 5.596 Mio € (31. Dezember 2006: 5.872 Mio €). Die Kennziffer Netto-Finanzverbindlichkeiten/EBITDA (Net Debt/EBITDA) verbesserte sich auf 2,7 zum 30. September 2007 und lag damit unter dem Stichtagswert zum 31. Dezember 2006 in Höhe von 3,0.
Anzahl der Mitarbeiterinnen und Mitarbeiter gestiegen
Zum 30. September 2007 waren im Konzern 110.379 Mitarbeiterinnen und Mitarbeiter weltweit beschäftigt (31. Dezember 2006: 104.872). Dies entspricht einem Zuwachs von 5 %.
Fresenius Biotech
Fresenius Biotech entwickelt innovative Therapien mit trifunktionalen Antikörpern zur Behandlung von Krebs sowie Zelltherapien zur Behandlung des Immunsystems. Mit ATG-Fresenius S, einem polyklonalen Antikörper, verfügt Fresenius Biotech über ein seit Jahren erfolgreich eingesetztes Immunsuppressivum zur Vermeidung und Behandlung der Abstoßung von transplantierten Organen.
Nach erfolgreichem Abschluss der Phase II/III-Studie mit removab® in der Indikation maligner Aszites soll die Einreichung der Zulassungsunterlagen bei der Europäischen Arzneimittelagentur EMEA (European Medicines Agency) zum Jahresende 2007 erfolgen.
Für die zukünftige Vermarktung von removab in den Regionen USA und Japan ist Fresenius Biotech in Gesprächen mit potenziellen Partnern.
Fresenius Biotech und Nabi Biopharmaceuticals haben ihre Partnerschaft bezüglich der klinischen Entwicklung und Vermarktung von ATG-Fresenius S in Nordamerika beendet. Fresenius Biotech übernimmt die Verantwortung für die Fortführung der klinischen Entwicklung und Registrierung von ATG-Fresenius S in den USA und wird die derzeit laufende Phase III-Studie selbst fortführen.
In den ersten drei Quartalen 2007 betrug der EBIT der Fresenius Biotech -33 Mio €. Für das Gesamtjahr 2007 geht Fresenius Biotech weiter davon aus, dass der EBIT bei rund -50 Mio € liegen wird (2006: -45 Mio €).
Die Unternehmensbereiche
Fresenius Medical Care
Fresenius Medical Care ist der weltweit führende Anbieter von Dienstleistungen und Produkten für Patienten mit chronischem Nierenversagen. Zum 30. September 2007 behandelte Fresenius Medical Care 172.227 Patienten in 2.221 Dialysekliniken.

- Sehr gutes organisches Umsatzwachstum von 7 %
- Deutliche Margensteigerung
- Ergebnisausblick am oberen Ende der Prognose erwartet
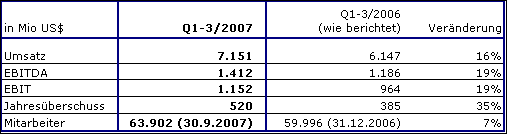
Fresenius Medical Care erreichte ein deutliches Umsatzplus von 16 % auf 7.151 Mio US$ (1.-3. Quartal 2006: 6.147 Mio US$). Diese Entwicklung ist im Wesentlichen zurückzuführen auf ein sehr gutes organisches Wachstum von 7 % und auf die Konsolidierung der Renal Care Group (RCG). Der Umsatz mit Dialysedienstleistungen stieg um 16 % auf 5.357 Mio US$ (1.-3. Quartal 2006: 4.628 Mio US$). Der Umsatz mit Dialyseprodukten wuchs um 18 % auf 1.794 Mio US$ (1.-3. Quartal 2006: 1.519 Mio US$).
In Nordamerika erhöhte sich der Umsatz um 14 % auf 4.957 Mio US$ (1.-3. Quartal 2006: 4.367 Mio US$). Der Umsatz außerhalb von Nordamerika (Segment „International") stieg in den ersten drei Quartalen um 23 % (währungsbereinigt: 15 %) auf 2.194 Mio US$ (1.-3. Quartal 2006: 1.780 Mio US$). Die Wachstumsraten bewegten sich im Berichtszeitraum sowohl in Europa, in der Region Asien-Pazifik als auch in Lateinamerika weiterhin auf hohem Niveau.
Der EBIT stieg um 19 % auf 1.152 Mio US$ (1.-3. Quartal 2006: 964 Mio US$ bzw. 936 Mio US$, adjustiert um den Ertrag aus dem Verkauf von Dialysekliniken in den USA und Einmalaufwendungen im Zusammenhang mit der Akquisition der RCG). Die EBIT-Marge lag bei 16,1 % (1.-3. Quartal 2006: 15,7 %, adjustiert 15,2 %). Der Jahresüberschuss erhöhte sich um 35 % auf 520 Mio US$ (1.-3. Quartal 2006: 385 Mio US$, inkl. Einmalaufwendungen von 20 Mio US$).
Fresenius Medical Care bekräftigt den Ausblick für das Gesamtjahr 2007 und rechnet weiterhin mit einem Umsatz von mehr als 9,5 Mrd US$. Dies entspricht einem Anstieg von mindestens 12 % im Vergleich zum Vorjahr. Beim Jahresüberschuss hatte das Unternehmen für 2007 bislang mit 685 bis 705 Mio US$ gerechnet. Wegen des sehr guten Geschäftsverlaufs im 3. Quartal erwartet Fresenius Medical Care nun, das obere Ende dieser Prognose zu erreichen.
Weitere Informationen: siehe Presse-Information Fresenius Medical Care unter www.fmc-ag.de.
Fresenius Kabi
Fresenius Kabi ist spezialisiert auf Infusionstherapien und klinische Ernährung für schwer und chronisch kranke Menschen im Krankenhaus und im ambulanten Bereich. Das Unternehmen ist ferner ein führender Anbieter von Produkten der Transfusionstechnologie.

- Sehr gutes organisches Umsatzwachstum von 7 %
- EBIT-Marge verbessert sich um 100 Basispunkte auf 16,2 %
- Ausblick 2007 voll bestätigt
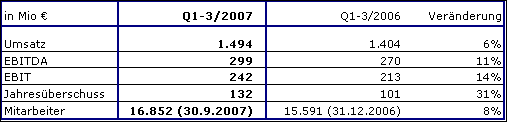
Fresenius Kabi steigerte den Umsatz um 6 % auf 1.494 Mio € (1.-3. Quartal 2006: 1.404 Mio €). Währungsumrechnungseffekte beeinflussten die Umsatzentwicklung negativ in Höhe von 2 %. Sie ergaben sich im Wesentlichen aus der Abschwächung der Währungen in Südafrika, China und Kanada. Das organische Umsatzwachstum betrug 7 %. Im 3. Quartal 2007 erreichte Fresenius Kabi ein ausgezeichnetes organisches Wachstum von 8 %.
In Europa (ohne Deutschland) stieg der Umsatz organisch um 5 %. In Deutschland betrug das organische Umsatzwachstum 1 %. In der Region Asien-Pazifik erreichte Fresenius Kabi ein hohes organisches Umsatzwachstum von 22 %. In Lateinamerika sowie in den sonstigen Regionen lag es bei 10 %.
Fresenius Kabi hat sein ausgezeichnetes Ergebniswachstum fortgesetzt. Der EBIT stieg um 14 % auf 242 Mio € (1.-3. Quartal 2006: 213 Mio €). Die EBIT-Marge lag bei 16,2 % (1.-3. Quartal 2006: 15,2 %). Der Jahresüberschuss stieg um 31 % auf 132 Mio € (1.-3. Quartal 2006: 101 Mio €, inkl. Einmalaufwendungen für Refinanzierung von 11 Mio €).
Fresenius Kabi bestätigt den Ausblick für das Geschäftsjahr 2007. Der Umsatz soll organisch um 6 bis 8 % steigen. Starke Wachstumsimpulse werden insbesondere aus den Regionen außerhalb Europas erwartet. Aufgrund der positiven Umsatzentwicklung sowie weiterer Prozessverbesserungen in Produktion und Logistik rechnet Fresenius Kabi im Geschäftsjahr 2007 mit einer EBIT-Marge von 16,0 bis 16,5 %.
Fresenius ProServe
Fresenius ProServe ist ein führender deutscher Krankenhausbetreiber mit 58 Kliniken. Das Leistungsspektrum umfasst weiterhin Engineering- und Dienstleistungen für Krankenhäuser und andere Gesundheitseinrichtungen.
- HELIOS erzielt weitere Margensteigerung
- VAMED gewinnt Auftrag mit einem Volumen von mehr als 100 Mio €
- Umsatzziel für 2007 voll bestätigt, EBIT-Ausblick erhöht
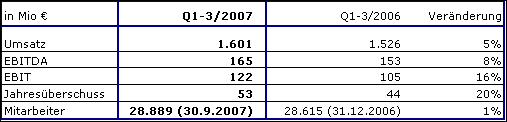
Fresenius ProServe erzielte einen Umsatzanstieg von 5 % auf 1.601 Mio € (1.-3. Quartal 2006: 1.526 Mio €). Das organische Wachstum betrug 1 %, beeinflusst durch verzögerte Projektumsätze bei der VAMED. Akquisitionen trugen in Höhe von 9 % zum Umsatzwachstum bei, während Desinvestitionen, vornehmlich der Verkauf von Pharmaplan und Pharmatec, einen negativen Einfluss von 5 % hatten.
Der EBIT stieg um 16 % auf 122 Mio € (1.-3. Quartal 2006: 105 Mio €).
Im Krankenhausbetreiber-Geschäft (HELIOS Kliniken Gruppe) stieg der Umsatz um 12 % auf 1.348 Mio € (1.-3. Quartal 2006: 1.204 Mio €). HELIOS erreichte ein sehr gutes organisches Wachstum von 3 %. Der EBIT stieg um 18 % auf 111 Mio € (1.-3. Quartal 2006: 94 Mio €). Die EBIT-Marge erhöhte sich um 40 Basispunkte auf 8,2 %. Im 3. Quartal 2007 erzielte HELIOS eine ausgezeichnete EBIT-Marge von 9,4 % (Q3 2006: 8,7 %).
Im Juli 2007 wurde ein Vertrag zum Erwerb des Krankenhauses Mariahilf in Hamburg-Harburg unterzeichnet. Ein Gerichtsverfahren, das gegen den Verkäufer des Krankenhauses gerichtet ist, verzögert derzeit den Abschluss der Transaktion.
Im Engineering- und Dienstleistungsgeschäft betrug der Umsatz 253 Mio € (1.-3. Quartal 2006: 322 Mio €). Der Rückgang resultiert im Wesentlichen aus dem Verkauf der Pharmaplan sowie der Pharmatec, die zum 1. Januar 2007 bzw. zum 30. Juni 2007 entkonsolidiert wurden. Das organische Wachstum betrug in den ersten drei Quartalen aufgrund von verzögerten Projektumsätzen bei der VAMED -7 %. Der EBIT belief sich auf 13 Mio € (1.-3. Quartal 2006: 14 Mio €).
Der Auftragseingang im Engineeringgeschäft betrug 245 Mio € (1.-3. Quartal 2006: 291 Mio €). Gründe für den Rückgang sind im Wesentlichen die Entkonsolidierung der vorgenannten Gesellschaften, ferner unterjährige Verschiebungen von Auftragseingängen. Im 3. Quartal 2007 stieg der Auftragseingang im Vergleich zum Vorjahresquartal um 31 %. Die VAMED erhielt einen Auftrag in Höhe von mehr als 100 Mio Euro. Dabei handelt es sich um die Errichtung einer Thermenanlage in Wien/Österreich mit integriertem Gesundheitszentrum. VAMED erwartet im Gesamtjahr 2007 einen Anstieg des Auftragseingangs gegenüber dem Jahr 2006.
Basierend auf dem hohen Auftragsbestand von 476 Mio € (31. Dezember 2006: 428 Mio €) und im Hinblick auf die Erwartungen für das 4. Quartal 2007 geht VAMED davon aus, den Umsatz im Jahr 2007 gegenüber dem Vorjahr steigern zu können.
Aufgrund der ausgezeichneten Geschäftsentwicklung im bisherigen Jahresverlauf erhöht Fresenius ProServe den EBIT-Ausblick für das Gesamtjahr 2007 von bislang ~170 Mio € auf mehr als 170 Mio €. Beim Umsatz wird unverändert ein organisches Wachstum von 2 bis 3 % erwartet.
Pressekonferenz
Anlässlich der Veröffentlichung der Geschäftszahlen für das 1.-3. Quartal 2007 findet in der Fresenius-Konzernzentrale in Bad Homburg am 31. Oktober 2007 um 10 Uhr MEZ eine Pressekonferenz statt. Die Übertragung der Pressekonferenz können Sie live über unsere Homepage unter Presse / Audio-Video-Service verfolgen. Nach der Veranstaltung steht Ihnen die Aufzeichnung als Video-on-demand zur Verfügung.
# # #
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.9.2007 beschäftigte der Fresenius-Konzern weltweit 110.379 Mitarbeiterinnen und Mitarbeiter.
PDF-Datei enthält:
Konzernzahlen auf einen Blick
-
Konzern-Gewinn- und Verlustrechnung (US-GAAP) (ungeprüft)
-
Kennzahlen der Konzernbilanz (US-GAAP) (ungeprüft)
-
Konzern-Kapitalflussrechnung (US-GAAP) (ungeprüft)
-
Segmentberichterstattung nach Unternehmensbereichen Q1-3 2007 (US-GAAP) (ungeprüft)
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.9.2007 beschäftigte der Fresenius-Konzern weltweit 110.379 Mitarbeiterinnen und Mitarbeiter.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts- und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Vorstand: Dr. Ulf M. Schneider (Vorsitzender), Rainer Baule, Andreas Gaddum, Dr. Jürgen Götz,
Dr. Ben Lipps, Stephan Sturm
Aufsichtsrat: Dr. Gerd Krick (Vorsitzender)
Sitz der Gesellschaft: Bad Homburg, Deutschland
Eingetragen beim Amtsgericht Bad Homburg, HRB 10660
PDF-Datei enthält:
Konzernzahlen auf einen Blick
- Konzern-Gewinn- und Verlustrechnung (US-GAAP) (ungeprüft)
- Kennzahlen der Konzernbilanz (US-GAAP) (ungeprüft)
- Konzern-Kapitalflussrechnung (US-GAAP) (ungeprüft)
- Segmentberichterstattung nach Unternehmensbereichen Q1-3 2007 (US-GAAP) (ungeprüft)
Zwei medizinische Studien haben erneut die Sicherheit und Wirksamkeit des Phosphatbinders PhosLo von Fresenius Medical Care bestätigt. Phosphatbinder werden chronisch nierenkranken Dialysepatienten verabreicht, um überschüssiges Phosphat im Blut abzubauen und dadurch eine Gefäßverkalkung oder Knochenschädigung zu verhindern. Die neuen Ergebnisse der CARE-2-Studie (Calcium Acetate Renagel Evaluation) stellte Dr. Wajeh Qunibi vom University of Texas Health Science Center in San Antonio auf der Renal Week 2007 Conference der American Society of Nephrology im kalifornischen San Francisco vor.
In der Studie wurden zwei Patientengruppen verglichen, von denen die eine mit PhosLo (Kalziumacetat) und die andere mit Renagel (Sevelamer Hydrochlorid) behandelt wurde. Die Studie zeigte, dass in den beiden Gruppen keine signifikanten Unterschiede bei der Entwicklung einer Verkalkung der Aorta und der Mitralklappe des Herzens bestehen, wenn die Blutfettwerte konstant gehalten werden. Eine erste Auswertung der Studie im vergangenen Jahr hatte bereits ergeben, dass es bei der allgemeinen kardiovaskulären Kalzifizierung (Verkalkung der Herzgefäße) keine Unterschiede zwischen beiden Gruppen gibt. Die nun veröffentlichten Ergebnisse belegen außerdem, dass das durch PhosLo ein Jahr lang täglich eingenommene Kalzium den Fortschritt der kardiovaskulären Kalzifizierung bei Dialysepatienten nicht beschleunigt.
Eine weitere im November in der Fachzeitschrift Kidney International veröffentlichte Studie zeigte, dass es zwischen mit PhosLo oder mit Renagel behandelten Patientengruppen keine statistisch signifikanten Unterschiede bei der kardiovaskulären Mortalitätsrate gibt. An der Studie nahmen insgesamt 2.100 Patienten teil. Eine Auswertung der Laborergebnisse ergab außerdem, dass die Patienten der PhosLo-Gruppe einen signifikant niedrigeren Serumphosphat- und Nebenschilddrüsenhormon-Spiegel als die Patienten der Renagel-Gruppe aufweisen (p<0,01). Bei der Untersuchung Dialysis Clinical Outcomes Revisited (DCOR) handelt es sich um eine interventionelle Ergebnisstudie.
Fresenius Medical Care hatte Anfang des Jahres bei der US-Arzneimittelbehörde FDA beantragt, PhosLo auch bei chronisch Nierenkranken einsetzen zu können, die noch keine Dialysebehandlung benötigen. Ein beratender Ausschuss der Behörde hat dies am 16. Oktober 2007 grundsätzlich befürwortet. Fresenius Medical Care wird weiter mit der FDA an einer Zulassung für die breitere Anwendung von PhosLo arbeiten.
Ben Lipps, Vorstandsvorsitzender von Fresenius Medical Care: „Die Ergebnisse der beiden Studien bestätigen uns darin, chronisch nierenkranken Patienten sichere und wirksame Medikamente anzubieten, mit denen Störungen des Mineralienhaushalts und eine Schädigung des Knochenbaus verhindert werden können. Medikamente für chronisch Nierenkranke sind Teil unserer Pharmatech-Therapie."
PhosLo, Renagel und Lipitor sind eingetragene Handelsmarken.
Über die CARE-2-Studie:
CARE-2 ist eine prospektive, randomisierte, kontrollierte Studie, bei der PhosLo und Renagel direkt (Head-to-Head) verglichen wurden. Die Patienten in beiden Gruppen erhielten – entsprechend ihrer Laborwerte – zusätzlich den Cholesterinsenker Lipitor (Atorvastatin Calcium), um den LDL-Cholesterinwert zu kontrollieren. Nach 12 Behandlungsmonaten waren zwischen den beiden Behandlungsgruppen keine statistisch signifikanten Unterschiede bei der Entwicklung der kardiovaskulären Kalzifizierung nachweisbar. Mit PhosLo und Renagel behandelte Patienten erreichten eine vergleichbare Reduzierung des Serumphosphatspiegels und des Kalzium-Phosphat-Produkts. Noch wichtiger ist, dass mit PhosLo die von der amerikanischen National Kidney Foundation in der „Kidney Disease Outcomes Quality Initiative" (K/DOQI) festgelegten Zielwerte deutlich schneller erreicht wurden.
Über PhosLo:
PhosLo ist ein aus Kalziumacetat bestehender Phosphatbinder zur oralen Verabreichung an chronisch nierenkranke Patienten. Überschüssiges Kalzium wird mit der Nahrung aufgenommen und bei gesunden Menschen von den Nieren abgebaut. Diese Funktion kann bei chronisch Nierenkranken nur teilweise durch die Dialyse ersetzt werden. Bei zu hohen Phosphatwerten im Blut besteht die Gefahr zu Knochenschädigungen, Schilddrüsenerkrankungen und zur vaskulären Kalzifizierung. Dieses Risken können Dialysepatienten durch die Einnahme von Phosphatbindern verringern. Der weltweite Phosphatbinder-Markt hat derzeit ein jährliches Umsatzvolumen von mehr als 500 Millionen US-Dollar.
Fresenius Medical Care ist der weltweit führende Anbieter von Produkten und Dienstleistungen für Menschen mit chronischem Nierenversagen, von denen sich weltweit mehr als 1,5 Millionen Patienten regelmäßig einer Dialysebehandlung unterziehen. In einem Netz aus 2.221 Dialysekliniken in Nordamerika, Europa, Asien, Lateinamerika und Afrika betreut Fresenius Medical Care 172.227 Dialysepatienten. Fresenius Medical Care ist ebenfalls der weltweit führende Anbieter von Dialyseprodukten wie Hämodialyse-Geräten, Dialysatoren und damit verbundenen Einweg-Produkten. Fresenius Medical Care ist an der Börse Frankfurt (FME, FME3) und an der Börse New York (FMS, FMS/P) notiert.
Weitere Informationen über Fresenius Medical Care im Internet unter www.fmc-ag.de.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius Medical Care übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Fresenius lädt in diesem Jahr erstmals zu einem Tag der offenen Tür speziell für angehende Auszubildende und Berufsakademie-Studenten in die Bad Homburger Konzernzentrale ein. Unter dem Motto „Ausbildung live" können junge Menschen am Samstag, 24. November, Einblick in die verschiedenen Ausbildungsberufe des Gesundheitskonzerns gewinnen. Fresenius zählt zu den 25 größten Ausbildungsbetrieben im Bezirk der Industrie- und Handelskammer Frankfurt am Main und bietet an den Standorten Bad Homburg, Oberursel und Friedberg jedes Jahr 45 Ausbildungsplätze in 17 verschiedenen Berufen an.
An Informationsständen werden die vielfältigen Ausbildungsmöglichkeiten für naturwissenschaftliche, technische, kaufmännische und informationstechnische Berufe gezeigt. Ausbilder und Auszubildende stehen für Fragen und Gespräche zur Verfügung. In Kurzvorträgen informieren die Ausbilder außerdem ausführlich über den Ablauf des Bewerbungsverfahrens und das Unternehmen. Potenzielle Bewerber sind dazu eingeladen, ihre mitgebrachten Bewerbungen unverbindlich und anonym vor Ort auf Inhalt und Form überprüfen zu lassen. Wer sich gut informiert fühlt, kann sein Wissen bei einem Gewinnspiel „Rund um die Ausbildungsberufe" testen und attraktive Preise wie MP3-Player und USB-Sticks gewinnen. Zwischendurch können sich die Besucher mit einem Imbiss stärken.
Der Tag der offenen Tür für angehende Auszubildende findet am Samstag, den 24. November 2007 von 9.00 bis 15.00 Uhr in der Konzernzentrale, Else-Kröner-Straße 1, in Bad Homburg statt. Weitere Informationen zur Ausbildung auf dieser Homepage unter Karriere / Ausbildung.
Hinweis an die Redaktionen: Wir laden Sie ein, den Tag der offenen Tür für Schulabgänger zu besuchen. Als Ansprechpartner steht Ihnen der Fresenius-Ausbildungsleiter Jürgen Muthig während der gesamten Zeit vor Ort zur Verfügung.
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.09.2007 beschäftigte der Fresenius-Konzern weltweit 110.379 Mitarbeiterinnen und Mitarbeiter.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Vorstand: Dr. Ulf M. Schneider (Vorsitzender), Rainer Baule, Andreas Gaddum, Dr. Jürgen Götz, Dr. Ben Lipps, Stephan Sturm
Aufsichtsrat: Dr. Gerd Krick (Vorsitzender)
Sitz der Gesellschaft: Bad Homburg, Deutschland/Eingetragen beim Amtsgericht Bad Homburg, HRB 10660
Die HELIOS Kliniken Gruppe, ein Unternehmen des Gesundheitskonzerns Fresenius, wird eine Mehrheitsbeteiligung an den Städtischen Krankenhäusern Krefeld übernehmen. Der Rat der Stadt Krefeld hat in seiner gestrigen Sitzung dem Verkauf von 74,9 Prozent der Anteile an HELIOS zugestimmt. Zu den Städtischen Krankenhäusern Krefeld gehören das Klinikum Krefeld und das Cäcilien-Hospital Krefeld-Hüls.
Das Klinikum Krefeld wird das fünfte Krankenhaus der Maximalversorgung im Verbund der HELIOS Kliniken nach Berlin-Buch, Schwerin, Wuppertal und Erfurt. Es verfügt über 1.023 Betten und versorgte im Jahr 2006 rund 35.400 Patienten. Das Cäcilien-Hospital zählt 182 Betten und behandelte etwa 4.600 Patienten. Die beiden Kliniken beschäftigen zusammen rund 3.300 Mitarbeiter und erzielten im vergangenen Jahr einen Umsatz von etwa 175 Mio €.
Über den Kaufpreis wurde Stillschweigen vereinbart. Die HELIOS Kliniken werden das Klinikum Krefeld als Einrichtung der Maximalversorgung sowie akademisches Lehrkrankenhaus fortentwickeln und das Cäcilien-Hospital durch ein erweitertes medizinisches Angebot langfristig sichern. Auf dem Gelände des Klinikums Krefeld wird HELIOS ein neues Klinikzentrum errichten, für das Cäcilien-Hospital ist eine Modernisierung geplant.
Der Kauf steht unter dem Vorbehalt der Zustimmung der Aufsichtsbehörden und des Kartellamtes. HELIOS geht davon aus, die Transaktion im ersten Halbjahr 2008 abschließen zu können.
„Die Akquisition ist eine der größten Klinikprivatisierungen der letzten Jahre und damit ein wichtiger Schritt in der Wachstumsstrategie von HELIOS. Mit den Städtischen Krankenhäusern Krefeld erwerben wir zwei sehr gut aufgestellte Krankenhäuser, die das HELIOS-Kliniknetz geografisch und medizinisch hervorragend ergänzen. Die Entscheidung der Stadt Krefeld für HELIOS spricht für den Erfolg unseres auf hohe Qualität und Transparenz ausgerichteten Privatisierungskonzepts", sagte Dr. Ulf M. Schneider, Vorstandsvorsitzender der Fresenius SE.
Die HELIOS Kliniken Gruppe betreibt 58 eigene Kliniken mit insgesamt rund 16.000 Betten, darunter vier Krankenhäuser der Maximalversorgung in Erfurt, Berlin-Buch, Wuppertal und Schwerin. Die 27.000 Mitarbeiter des Unternehmens leisten jährlich rund 460.000 stationäre Behandlungen und erwirtschafteten im Jahr 2006 einen Umsatz von rund 1,7 Mrd €.
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.09.2007 beschäftigte der Fresenius-Konzern weltweit 110.379 Mitarbeiterinnen und Mitarbeiter.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Vorstand: Dr. Ulf M. Schneider (Vorsitzender), Rainer Baule, Andreas Gaddum, Dr. Jürgen Götz, Dr. Ben Lipps, Stephan Sturm
Aufsichtsrat: Dr. Gerd Krick (Vorsitzender)
Sitz der Gesellschaft: Bad Homburg, Deutschland/Eingetragen beim Amtsgericht Bad Homburg, HRB 10660
Fresenius Kabi, ein Unternehmen des Gesundheitskonzerns Fresenius, hat mit Nestlé S.A. eine Vereinbarung zum Erwerb der enteralen Ernährungsgeschäfte von Nestlé in Frankreich (Novartis Nutrition S.A.S.) und in Spanien (Nestlé Espana) getroffen. Fresenius Kabi stärkt mit dieser Akquisition ihren wachstumsstarken Bereich Klinische Ernährung und baut die Marktstellung in Frankreich und Spanien deutlich aus.
Novartis Nutrition zählt zu den führenden Anbietern enteraler Ernährung in Frankreich. Das Unternehmen bietet ein umfassendes Sortiment an Trink- und Sondennahrungen sowie die zugehörigen medizintechnischen Produkte an. Fresenius Kabi wird durch den Erwerb des Ernährungsgeschäfts von Novartis Nutrition zweitgrößter Anbieter für enterale Ernährungsprodukte in Frankreich.
Nestlé Espana hat sich als renommierter Anbieter enteraler Ernährungsprodukte in den letzten Jahren erfolgreich auf dem spanischen Markt etabliert. Durch diese Akquisition erlangt Fresenius Kabi Zugang zum spanischen Markt für enterale Ernährung.
Im Jahr 2007 wird ein Umsatz beider Geschäfte von rund 55 Mio € erwartet. ´
Die Europäische Kommission hatte Nestlé im Zusammenhang mit dem Kauf des weltweiten klinischen Ernährungsgeschäfts von Novartis den Verkauf der beiden Geschäfte auferlegt. Die Zustimmung der Europäischen Kommission und die Anhörung und Information der Arbeitnehmervertreter in Frankreich und Spanien, beides Voraussetzungen für den Vollzug der Transaktion, sind zwischenzeitlich erfolgt.
Über den Kaufpreis wurde Stillschweigen vereinbart.
Der Abschluss der Akquisition wird noch im Jahr 2007 erwartet.
Klinische Ernährung:
In der klinischen Ernährung bietet Fresenius Kabi parenterale (intravenös zu verabreichende) und enterale (über den Magen-Darm-Trakt zu verabreichende) Ernährungsprodukte sowie Ernährungspumpen und Einmalartikel zur Applikation an.
Fresenius ist ein weltweit tätiger Gesundheitskonzern mit Produkten und Dienstleistungen für die Dialyse, das Krankenhaus und die medizinische Versorgung von Patienten zu Hause. Im Geschäftsjahr 2006 erzielte das Unternehmen einen Umsatz von rund 10,8 Milliarden Euro. Zum 30.09.2007 beschäftigte der Fresenius-Konzern weltweit 110.379 Mitarbeiterinnen und Mitarbeiter.
Fresenius Kabi ist in der Infusionstherapie und in der klinischen Ernährung Marktführer in Europa und in ihren wichtigsten Ländern in Lateinamerika und Asien- Pazifik. Zum Kerngeschäft zählen Infusionslösungen zum Flüssigkeits- und Blutvolumenersatz, zur parenteralen Ernährung und Produkte zur enteralen Ernährung. Gleichzeitig bietet das Unternehmen Konzepte für die ambulante Gesundheitsversorgung an und ist auf die Organisation und Durchführung ambulanter Therapien spezialisiert. Mit der Philosophie „Caring for Life" und einem umfassenden Produktprogramm steht das Unternehmen für die Verbesserung der Lebensqualität von Patienten weltweit. Zum 30. September 2007 beschäftigte Fresenius Kabi 16.852 Mitarbeiterinnen und Mitarbeiter. Im Geschäftsjahr 2006 wurde ein Umsatz von 1.893 Millionen Euro erzielt und ein operatives Ergebnis von 291 Millionen Euro erwirtschaftet. Fresenius Kabi AG ist eine hundertprozentige Tochtergesellschaft der Fresenius SE.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Vorstand: Dr. Ulf M. Schneider (Vorsitzender), Rainer Baule, Andreas Gaddum, Dr. Jürgen Götz, Dr. Ben Lipps, Stephan Sturm
Aufsichtsrat: Dr. Gerd Krick (Vorsitzender)
Sitz der Gesellschaft: Bad Homburg, Deutschland/Eingetragen beim Amtsgericht Bad Homburg, HRB 10660
Fresenius Medical Care übernimmt das US-amerikanische Unternehmen Renal Solutions, Inc. (RSI). Mit der Akquisition von RSI erwirbt Fresenius Medical Care eine wesentliche Technologie für den Ausbau der Heim-Hämodialyse. Darüber hinaus bietet diese Technologie eine Grundlage für die Entwicklung einer tragbaren künstlichen Niere.
Die Vereinbarung umfasst die Zahlung von insgesamt bis zu 190 Millionen US-Dollar, davon 100 Millionen US-Dollar beim Kaufabschluss, weitere 60 Millionen US-Dollar nach einem Jahr sowie Meilensteinzahlungen von bis zu 30 Millionen US-Dollar über die nächsten drei Jahre. Die Verbindlichkeiten von RSI zum Zeitpunkt des Kaufabschlusses betrugen 10 Millionen US-Dollar.
Die SORB-Technologie des Hämodialysesystems Allient Sorbent von RSI ermöglicht es, Leitungswasser für die Dialyse aufzubereiten und die Dialyseflüssigkeit wiederzuverwenden. Der SORB-Filter hat sich auf dem Hämodialysemarkt bewährt und wurde bereits 6 Millionen Mal verkauft. RSI hält auf dem Gebiet der SORB-Technologie Schlüsselpatente und weltweite geistige Eigentumsrechte. Für eine Dialysebehandlung werden nur noch sechs Liter Trinkwasser benötigt statt bislang etwa 120 Liter Reinstwasser aus Umkehrosmoseanlagen. Die raum- und wassersparende Technologie eignet sich deshalb besonders gut für die Heim-Hämodialyse.
Die Kombination der Hämodialysetechnologie des Marktführers Fresenius Medical Care mit der SORB-Technologie von RSI ermöglicht es, eine neue Generation von Heim-Hämodialyseprodukten zu entwickeln. Darüber hinaus trägt die SORB-Technologie mit ihrem deutlich verringerten Wasserverbrauch wesentlich zur Miniaturisierung bei – ein wichtiger Schritt auf dem Weg zu einer tragbaren künstlichen Niere.
Fresenius Medical Care beziffert das Marktvolumen für Heimdialyse (Bauchfelldialyse und Heim-Hämodialyse) auf etwa zwei Milliarden US-Dollar. Dies entspricht etwa elf Prozent des weltweiten Dialysemarkts. Der Markt für Heimdialyse hat das Potenzial, in den nächsten zehn Jahren auf vier Milliarden US-Dollar zu wachsen. Der Marktanteil von Fresenius Medical Care beträgt in diesem Marktsegment derzeit etwa 30 Prozent. Die Heim-Hämodialyse war in den vergangenen Jahren ein Nischenmarkt, dessen Bedeutung in jüngster Zeit zugenommen hat. Ende 2006 lag der Anteil der Heim-Hämodialysepatienten an der Gesamtzahl der Dialysepatienten in Nordamerika bei etwa 0,5 Prozent. Mit zunehmender Verfügbarkeit adäquater Therapieoptionen könnte dieser Anteil in den nächsten 10 Jahren auf etwa 4 Prozent steigen.
Dr. Ben Lipps, Vorstandsvorsitzender von Fresenius Medical Care: „Die Übernahme von Renal Solutions ist ein wichtiger Schritt zur Weiterentwicklung unserer Technologieführerschaft auf diesem stark wachsenden Gebiet. Sie bietet uns die Chance auf eine dauerhaft führende Position auch bei Produkten für die Heim- und Akutdialyse. Darüber hinaus ermöglicht die Kombination unserer Dialysetechnologie mit der SORB-Technologie die Entwicklung von innovativen Produkten wie tragbaren künstlichen Nieren. In Zusammenhang mit der Akquisition rechnet Fresenius Medical Care mit einer Steigerung der jährlichen Forschungs- und Entwicklungsausgaben ab 2008 um 10 Millionen US-Dollar. Unsere mittelfristigen Finanzziele für 2007 bis 2010 bleiben unverändert."
Fresenius Medical Care ist der weltweit führende Anbieter von Produkten und Dienstleistungen für Menschen mit chronischem Nierenversagen, von denen sich weltweit mehr als 1,5 Millionen Patienten regelmäßig einer Dialysebehandlung unterziehen. In einem Netz aus 2.221 Dialysekliniken in Nordamerika, Europa, Asien, Lateinamerika und Afrika betreut Fresenius Medical Care 172.227 Dialysepatienten. Fresenius Medical Care ist ebenfalls der weltweit führende Anbieter von Dialyseprodukten wie Hämodialyse-Geräten, Dialysatoren und damit verbundenen Einweg-Produkten. Fresenius Medical Care ist an der Börse Frankfurt (FME, FME3) und an der Börse New York (FMS, FMS/P) notiert.
Weitere Informationen über Fresenius Medical Care im Internet unter www.fmc-ag.de.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zur Zeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts-, und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Fresenius Medical Care übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.



